Factores de riesgo en cáncer de próstata
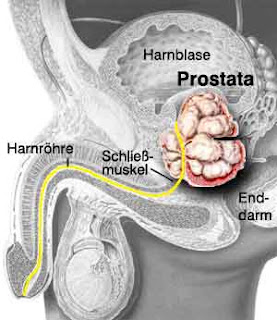
Los factores que más aumentan el riesgo de desarrollar cáncer de próstata son los factores genéticos, nutricionales, ambientales y los factores hormonales derivados de los andrógenos. Edad El cáncer de próstata se presenta usualmente en hombres mayores de 40 años y su frecuencia aumenta con la edad especialmente después de los 50 años. Se estima que al menos 65% de los hombres de más de 70 años tienen evidencia microscópica de cáncer prostático, pero afortunadamente su crecimiento es muy lento y los hombres en la tercera edad casi siempre fallecen de una causa diferente. Historia familiar y factores genéticos Los factores hereditarios juegan un papel importante y los hombres con historia familiar de cáncer de próstata tienen mayor riesgo de desarrollarlo. El tener un familiar con cáncer de próstata dobla el riesgo de desarrollarlo, y el tener 3 familiares con cáncer de próstata aumenta 11 veces el riesgo de desarrollarlo. Raza Los hombres afroamericanos tienen el más alto riesgo de des...